Substâncias Simples E Compostas – Toda Matéria: A matéria que nos cerca, de tudo, desde o ar que respiramos até os alimentos que consumimos, é composta por substâncias, que podem ser classificadas como simples ou compostas. Essa distinção fundamental, baseada na composição atômica, define suas propriedades e comportamentos. Vamos mergulhar nesse universo microscópico para entender melhor a estrutura e as reações químicas que moldam nosso mundo.
Exploraremos as diferenças cruciais entre substâncias simples, formadas por átomos de um único elemento, e substâncias compostas, resultantes da combinação de dois ou mais elementos. Veremos exemplos do cotidiano, desde o oxigênio que necessitamos para respirar até a água que bebemos, analisando suas propriedades e aplicações. Além disso, investigaremos como as reações químicas permitem a transformação de uma substância em outra, um processo fundamental para a compreensão da natureza dinâmica da matéria.
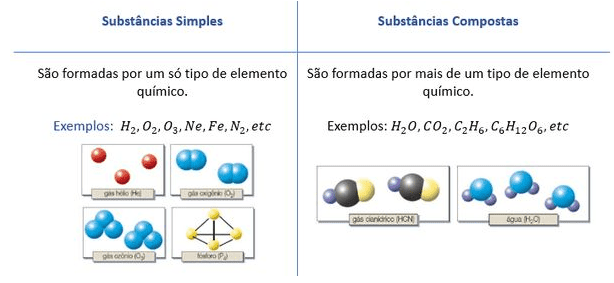
Diferenciando Substâncias Simples e Compostas

A distinção fundamental entre substâncias simples e compostas reside na sua composição atômica. Substâncias simples são formadas por átomos de um único elemento químico, enquanto substâncias compostas são formadas por átomos de dois ou mais elementos químicos diferentes, unidos por ligações químicas. Essa diferença básica impacta significativamente suas propriedades físicas e químicas.
Composição Atômica de Substâncias Simples e Compostas

Substâncias simples, por definição, contêm apenas um tipo de átomo. Por exemplo, o oxigênio gasoso (O₂) é uma substância simples, pois é constituído apenas por átomos de oxigênio ligados entre si. Já as substâncias compostas apresentam átomos de diferentes elementos químicos combinados em proporções definidas. A água (H₂O), por exemplo, é uma substância composta, pois contém átomos de hidrogênio e oxigênio unidos em uma proporção de 2:1.
A ligação química entre esses átomos é crucial para a formação da molécula de água e suas propriedades características. A variedade de combinações possíveis entre diferentes elementos químicos resulta na enorme diversidade de substâncias compostas existentes na natureza.
Propriedades Físicas e Químicas: Comparação entre Substâncias Simples e Compostas
As propriedades físicas e químicas de uma substância simples, como o oxigênio (O₂), diferem significativamente das de uma substância composta, como a água (H₂O). O oxigênio, em condições ambientes, é um gás incolor, inodoro e insípido, essencial para a respiração. Sua reatividade química é alta, participando de diversas reações de combustão. A água, por sua vez, é um líquido incolor, inodoro e com sabor característico em condições ambientes.
Apresenta ponto de ebulição e fusão específicos, além de propriedades como tensão superficial e capacidade de dissolver muitas substâncias, características que a tornam essencial para a vida. A diferença nas propriedades decorre da diferente estrutura molecular e das diferentes interações entre os átomos que compõem cada substância.
Exemplos de Substâncias Simples e Compostas
A tabela a seguir apresenta exemplos de substâncias simples e compostas, suas fórmulas químicas e uma breve descrição de suas propriedades.
| Nome da Substância | Fórmula Química | Tipo | Propriedades |
|---|---|---|---|
| Oxigênio | O₂ | Simples | Gás incolor, inodoro e insípido; essencial para a respiração; altamente reativo. |
| Ferro | Fe | Simples | Sólido metálico, prateado e brilhante; dúctil e maleável; reage com o oxigênio e a água. |
| Enxofre | S₈ | Simples | Sólido amarelo, quebradiço; mau condutor de eletricidade; utilizado na produção de ácido sulfúrico. |
| Água | H₂O | Composta | Líquido incolor, inodoro e com sabor característico; solvente universal; essencial para a vida. |
| Cloreto de Sódio | NaCl | Composta | Sólido cristalino branco; solúvel em água; utilizado como sal de cozinha. |
| Glicose | C₆H₁₂O₆ | Composta | Sólido cristalino branco; solúvel em água; fonte de energia para os seres vivos. |
Substâncias Simples e Compostas no Cotidiano: Substâncias Simples E Compostas – Toda Matéria

A compreensão da diferença entre substâncias simples e compostas é fundamental para entendermos a composição da matéria ao nosso redor, desde os alimentos que consumimos até os materiais utilizados na construção de nossas casas e na fabricação dos produtos que usamos diariamente. Neste tópico, exploraremos exemplos concretos de substâncias simples e compostas presentes no nosso cotidiano, analisando seus usos e impactos.
Substâncias Simples no Dia a Dia
As substâncias simples, formadas por apenas um tipo de átomo, estão presentes em diversos materiais que utilizamos constantemente. A seguir, cinco exemplos ilustram sua importância em nosso cotidiano:
- Oxigênio (O2): Essencial para a respiração de todos os seres vivos, o oxigênio é fundamental para a produção de energia em nossas células. Encontra-se no ar que respiramos, representando aproximadamente 21% de sua composição.
- Nitrogênio (N2): Constitui cerca de 78% do ar atmosférico. Embora inerte para a maioria dos seres vivos na sua forma gasosa, o nitrogênio é crucial para a produção de fertilizantes, essenciais para a agricultura.
- Ferro (Fe): Metal utilizado na construção civil, na fabricação de automóveis e em diversos utensílios domésticos. Sua importância biológica é evidente, sendo componente essencial da hemoglobina, proteína responsável pelo transporte de oxigênio no sangue.
- Enxofre (S): Utilizado na produção de ácido sulfúrico, um importante reagente químico industrial, e também na fabricação de fertilizantes e medicamentos.
- Carbono (C): Na forma de grafite, é usado em lápis e lubrificantes. Como diamante, é uma gema preciosa. É a base de toda a química orgânica, formando a estrutura de todas as moléculas orgânicas, incluindo as que constituem os seres vivos.
Substâncias Compostas em Alimentos e Nutrição Humana
Muitos alimentos que consumimos diariamente são compostos por diversas substâncias químicas, sendo a maioria delas substâncias compostas. A seguir, três exemplos demonstram o papel dessas substâncias na nossa nutrição:
- Água (H2O): Fundamental para todas as funções vitais do organismo, a água participa de reações químicas, regula a temperatura corporal e transporta nutrientes.
- Glicose (C6H 12O 6): Principal fonte de energia para as células, a glicose é obtida através da digestão de carboidratos presentes em alimentos como frutas, pães e massas.
- Cloreto de Sódio (NaCl): Conhecido como sal de cozinha, o cloreto de sódio é essencial para o equilíbrio eletrolítico do corpo, regulando a pressão sanguínea e a transmissão de impulsos nervosos. Seu consumo deve ser moderado para evitar problemas de saúde.
Impacto Ambiental da Produção e Uso de Substâncias Simples e Compostas
A produção e o uso de substâncias simples e compostas, embora essenciais para o desenvolvimento tecnológico e econômico, podem gerar impactos ambientais significativos. A seguir, analisaremos alguns exemplos:
- Substâncias Simples:
- Extração de Ferro: A mineração e o processamento do minério de ferro geram grandes quantidades de resíduos, contaminando o solo e a água com metais pesados. A emissão de gases de efeito estufa durante a produção de ferro também contribui para o aquecimento global.
- Produção de Enxofre: A extração e o processamento do enxofre podem liberar dióxido de enxofre (SO 2) na atmosfera, contribuindo para a chuva ácida e a poluição do ar.
- Substâncias Compostas:
- Plásticos (polímeros): A produção de plásticos, derivados do petróleo, demanda grandes quantidades de energia e libera gases de efeito estufa. A dificuldade de degradação dos plásticos gera acúmulo de lixo e poluição dos oceanos e solos.
- Pesticidas: O uso indiscriminado de pesticidas pode contaminar o solo, a água e os alimentos, afetando a saúde humana e a biodiversidade. Muitos pesticidas são persistentes no meio ambiente, acumulando-se na cadeia alimentar.
Reações Químicas e Transformações da Matéria
As reações químicas são processos que envolvem a reorganização de átomos, resultando na formação de novas substâncias com propriedades diferentes das substâncias originais. Essas transformações são fundamentais para compreender a diversidade da matéria e seus comportamentos. Neste contexto, analisaremos como reações químicas transformam substâncias compostas em simples e vice-versa, além de ilustrar uma sequência de reações químicas que resultam na transformação de uma substância composta em outra.
Decomposição de uma Substância Composta em Substâncias Simples
Uma reação química pode transformar uma substância composta em substâncias simples através de um processo chamado decomposição. Nesse processo, uma substância composta se quebra em duas ou mais substâncias mais simples. Um exemplo clássico é a eletrólise da água, onde a água (H₂O), uma substância composta, é decomposta em seus elementos constituintes, hidrogênio (H₂) e oxigênio (O₂), ambos substâncias simples.
A reação ocorre na presença de uma corrente elétrica, que fornece a energia necessária para quebrar as ligações químicas entre os átomos de hidrogênio e oxigênio. A equação química balanceada para essa reação é:
2H₂O(l) → 2H₂(g) + O₂(g)
Neste caso, a água líquida (l) é decomposta em hidrogênio gasoso (g) e oxigênio gasoso (g). Observe que a equação está balanceada, com dois átomos de hidrogênio e um átomo de oxigênio em cada lado da equação.
Combinação de Substâncias Simples para Formar uma Substância Composta
Substâncias simples podem se combinar para formar substâncias compostas através de reações de síntese ou adição. Um exemplo é a formação de água a partir da reação entre hidrogênio e oxigênio. Ambos são gases, substâncias simples, que ao reagirem em condições adequadas (presença de uma faísca, por exemplo), combinam-se para formar água, uma substância composta. A equação química balanceada para essa reação é:
2H₂(g) + O₂(g) → 2H₂O(l)
Nesta reação, dois mols de hidrogênio gasoso reagem com um mol de oxigênio gasoso para produzir dois mols de água líquida. A reação é altamente exotérmica, liberando uma grande quantidade de energia na forma de calor e luz.
Sequência de Reações Químicas: Transformação de uma Substância Composta em Outra, Substâncias Simples E Compostas – Toda Matéria
Vamos considerar a transformação do carbonato de cálcio (CaCO₃) em óxido de cálcio (CaO). Essa transformação envolve uma sequência de reações químicas.
Etapa 1: Decomposição térmica do carbonato de cálcio. O carbonato de cálcio, quando aquecido a altas temperaturas, se decompõe em óxido de cálcio e dióxido de carbono. A equação química é: CaCO₃(s) → CaO(s) + CO₂(g)
Etapa 2: Reação do óxido de cálcio com água. O óxido de cálcio reage vigorosamente com a água, formando hidróxido de cálcio, também conhecido como cal hidratada. A equação química é: CaO(s) + H₂O(l) → Ca(OH)₂(aq)
Esta sequência demonstra como uma substância composta (carbonato de cálcio) pode ser transformada em outra (hidróxido de cálcio) através de uma série de reações químicas, envolvendo decomposição e reação com água. Cada etapa envolve a quebra e formação de ligações químicas, resultando em mudanças nas propriedades químicas e físicas das substâncias envolvidas.
Em resumo, a compreensão das diferenças entre substâncias simples e compostas é essencial para entender a complexidade da matéria e os processos químicos que regem o nosso mundo. Desde a respiração até a produção industrial, essas substâncias desempenham papéis vitais, e o conhecimento de suas propriedades e reações é fundamental para o desenvolvimento tecnológico e a sustentabilidade ambiental. A capacidade de transformar substâncias umas nas outras abre portas para inovações em diversas áreas, mostrando a importância contínua do estudo da química em nosso dia a dia.

